De effecten van COVID-19 op de prestaties van de ademhalingsspier:
OverzichtDe effecten van COVID-19 op de prestaties van de ademhalingsspier: pleiten voor het testen en trainen van de ademhalingsspier.
Samenvatting van een wetenschappelijk onderzoek.
Ernstig acuut respiratoir syndroom coronavirus 2 (SARS-CoV-2) infectie resulteert in schade aan meerdere organen, voornamelijk gemedieerd door virale infiltratie viaangiotensine-converterende enzym-2-receptoren op het oppervlak van cellen.
Een primair symptoom voor veel patiënten is kortademigheid bij inspanning, die zelfs na herstel van de virale infectie kan aanhouden.
De prestaties van de ademhalingsspier (RM) werden verondersteld een factor te zijn die bijdraagt aan de ernst van symptomen van coronavirusziekte 2019 (COVID-19), zoals dyspneu, en de uitkomsten.
Dit werd toegeschreven aan overeenkomsten tussen patiëntenpopulaties met een verhoogd risico op ernstige COVID-19-symptomen en patiënten met een grotere kans op baseline RM-zwakte en de effecten van langdurige mechanische ventilatie.
Meer recent bewijs suggereert dat SARS-CoV-2-infectie zelf schade aan de RM kan veroorzaken, en veel patiënten die hersteld zijn, melden aanhoudende dyspneu ondanks milde gevallen, normale longfunctie of onbeschadigd longparenchym.
Deze recentere bevindingen suggereren dat de rol van RM bij de aanhoudende dyspneu als gevolg van COVID-19 groter kan zijn dan oorspronkelijk werd aangenomen.
Daarom lijkt screening op RM-zwakte en het bieden van interventies om de RM-prestaties te verbeteren belangrijk voor patiënten met COVID-19.
Dit artikel gaat in op de impact van SARS-CoV-2-infectie op RM-prestaties en biedt klinische aanbevelingen voor screening van RM-prestaties en behandelingsinterventies.
Invoering
Bij de start van de pandemie van de coronavirusziekte 2019 (COVID-19) ging de meeste aandacht uit naar de effecten van het ernstige acute respiratoire syndroom coronavirus 2 (SARS-CoV-2) op de longen.
Dit kwam omdat SARS-CoV-2 het lichaam infiltreert via de slijmvliezen in de nasopharynx en het strottenhoofd en coronavirussen typisch de luchtwegen aantasten [ 1 , 2 ].
Bovendien ontwikkelden veel patiënten met ernstige COVID-19 acuut respiratoir distress syndroom (ARDS) en respiratoire insufficiëntie die mechanische beademing (MV) nodig hadden [ 1 ].
Het is nu duidelijk dat SARS-CoV-2-infectie resulteert in schade aan meerdere organen, voornamelijk gemedieerd door virale infiltratie via angiotensine-converting enzyme-2 (ACE-2)-receptoren op het oppervlak van cellen [ 1, 3 ].
De omvang van deze schade aan organen blijft echter onduidelijk, vooral in gevallen van COVID-19 waarvoor geen ziekenhuisopname nodig is [ 3 ].
Wat consistent is in veel gevallen, ongeacht de ernst, zijn symptomen van inspanningsdyspneu die aanhouden na acuut herstel van de virale infectie.
Ongeveer 82% van de gehospitaliseerde patiënten en 38% van de niet-gehospitaliseerde patiënten met COVID-19 ontwikkelt dyspneu [ 4 ]. 2 maanden na ziekenhuisopname is gemeld dat 43% van de patiënten met COVID-19 nog steeds dyspneu kan ervaren [ 5 ].
Symptomen van dyspneu kunnen zelfs bij niet-gehospitaliseerde patiënten aanhouden [ 5 ].
Bij patiënten met PCR-bevestigde COVID-19, B liddal et al. [ 6] ontdekte dat 10% nog steeds symptomen van dyspneu meldde, zowel 4 als 12 weken na de diagnose.
De prevalentie van aanhoudende dyspneu in zowel milde als ernstige gevallen kan echter nog groter zijn.
Een online-enquêtestudie door Goërtz et al. [ 7 ] ontdekte dat meer dan 71% van de patiënten met COVID-19 die nooit in het ziekenhuis waren opgenomen, 79 dagen na infectie last hadden van dyspneu.
Gezien de impact die dyspneu heeft op belangrijke klinische resultaten zoals fysieke activiteit, psychologisch welzijn en kwaliteit van leven [ 4 ], is het identificeren en aanpakken van bijdragende factoren cruciaal voor een effectieve behandeling van patiënten met COVID-19.
In het begin van de pandemie werd verondersteld dat de prestaties van de ademhalingsspier (RM) een factor waren die bijdraagt aan de ernst van de symptomen en uitkomsten van COVID-19 [ 8 ].
De basis voor deze vroege hypothese was dat patiënten met een risico op ernstige COVID-19-symptomen en slechte resultaten populaties zijn waar RM-zwakte en verhoogde ademhalingseisen vaker voorkomen [ 8 ].
Een virale infectie zoals SARS-CoV-2, die ontstekingsschade aan het longparenchym veroorzaakt en de longcompliantie vermindert, kan een nog grotere onbalans veroorzaken tussen de eisen van de ademhaling (Pibr) en het RM-krachtgenererend vermogen (Pimax) [ 8 ] .
Bovendien kunnen patiënten met ernstige gevallen van COVID-19 die MV vereisen, snelle RM-atrofie en zwakte ervaren, wat deze onbalans verder kan verergeren [8 , 9 ].
Meer recent bewijs suggereert dat SARS-CoV-2-infectie zelf schade aan de RM kan veroorzaken [ 9 , 10 ], en veel patiënten die hersteld zijn van COVID-19 melden aanhoudende dyspneu ondanks milde gevallen [ 6 , 7 ] normale longfunctie [ 11 ] of onbeschadigd longparenchym [ 12]. Dit suggereert dat de rol van de RM bij de aanhoudende dyspneu die wordt gemeld door patiënten met COVID-19 mogelijk groter is dan oorspronkelijk werd aangenomen.
Daarom lijkt screening op RM-zwakte en het bieden van interventies om de RM-prestaties te verbeteren belangrijk voor patiënten met COVID-19.
Dit artikel gaat in op de impact van COVID-19-infectie op de RM-prestaties en biedt klinische aanbevelingen voor screening van RM-prestaties en behandelingsinterventies.
Impact van MV op RM-prestaties
De behandeling van patiënten met ernstige gevallen van COVID-19 vereist vaak MV om de oxygenatie en ventilatie te verbeteren en het ademen te verminderen.
Hoewel MV een cruciale levensreddende interventie is voor patiënten met een kritieke ziekte, zijn er grote fysiologische gevolgen die daaruit kunnen voortvloeien.
Een opmerkelijk nadelig gevolg van MV dat consequent is gemeld, is de diepe en snelle atrofie en zwakte van de RM's [ 13 , 14 ].
Deze acute pathologie van de RM tijdens MV is klassiek gerapporteerd in het middenrif en wordt ventilator-geïnduceerde diafragmadisfunctie (VIDD) genoemd [ 13 ].
De prevalentie van VIDD is naar verluidt 79% wanneer beoordeeld tijdens een verblijf op de intensive care (ICU) [ 15] en kan zelfs optreden binnen 18 uur na het starten van MV [ 13 ]. G rosu et al. [ 16 ] rapporteerde dat patiënten onder MV een vermindering van de dikte van de middenrifspier vertoonden met een snelheid van 6% per dag.
Jaber et al. [ 17 ] meldde dat 1 week MV resulteert in een vermindering van de RM-sterkte met 32%, beoordeeld via tracheale luchtwegdruk.
Hoewel deze acute veranderingen in de RM na MV voornamelijk in het middenrif zijn gemeld, hebben bevindingen uit recentere onderzoeken aangetoond dat veranderingen in de extra-diafragmatische RM ook kunnen optreden.
N akanishi et al. [ 18] rapporteerde dat 76% van de patiënten met diafragmaatrofie na MV gelijktijdige verminderingen van de intercostale spierdikte vertoonden.
Interessant is dat een subgroep van patiënten in datzelfde cohort veranderingen in de dikte van de intercostale spieren liet zien, onafhankelijk van of in de tegenovergestelde richting van veranderingen in de dikte van de middenrifspier.
De meerderheid van de patiënten in dat cohort vertoonde echter veranderingen in zowel het diafragma als de intercostales in dezelfde richting [ 18 ].
Bovendien is pathologie van de uitademingsspieren ook gemeld bij patiënten met kritieke ziekte die MV nodig hebben en kan ook onafhankelijk van veranderingen in het middenrif optreden [ 19 ].
Meerdere pathofysiologische mechanismen zijn toegeschreven aan deze veranderingen in de RM na MV, waaronder maar niet beperkt tot spierproteolyse, disfunctie van de contractiele elementen, mitochondriale disfunctie en oxidatieve stress [ 14 , 20-23 ] .
Er is gesuggereerd dat het onderliggende pathofysiologische mechanisme dat dit veroorzaakt de inflammatoire toestand van kritieke ziekte is [ 21 , 24 ].
Verschillende onderzoeken hebben echter aangetoond dat bijvoorbeeld VIDD zich zelfs zonder sepsis kan ontwikkelen en geen systemische inflammatoire toestand vereist [ 13 , 21].
Eén theorie is dat inactiviteit van de RM die optreedt onder MV de belangrijkste factor kan zijn, vooral bij continue verplichte ventilatie [ 20 , 21 ].
Gedeeltelijke ondersteuning MV, waarbij enige RM-activiteit behouden blijft, is aangetoond dat het spierproteolyse van het middenrif voorkomt, wat kan helpen beschermen tegen de ontwikkeling van VIDD [ 14 , 21 ].
Hoewel deze acute verminderingen van de RM-kracht ingrijpend kunnen zijn en het vermogen van patiënten om succesvol van MV te worden gespeend, kunnen aantasten, zijn de eisen van ademademhaling over het algemeen ver onder de typische capaciteit van de RM (Pibr/Pimax).
Getijdeademhaling bij gezonde personen vereist slechts ∼5–10 cmH 2 O en ∼ 40 cmH 2 O om de longblaasjes van een gezonde long volledig te rekruteren [ 25–27 ].
De gemiddelde maximale inspiratoire druk (MIP) die wordt gegenereerd door gezonde volwassen mannen van 18–29 jaar is 128 cmH 2 O (116,3–139,5 cmH 2 O) en 97 cmH 2 O (88,6–105,4 cmH 2 O) voor vrouwen [ 28].
Daarom zou zelfs een hypothetische vermindering van 50% van de piek-RM-sterkte veroorzaakt door MV bij een gezonde volwassene de eisen van ademademhaling op minder dan 10% van hun capaciteit stellen.
Bij patiënten met onderliggende RM-zwakte kunnen de acute stoornissen als gevolg van MV er echter toe leiden dat de eisen van de ademademhaling de piekcapaciteit van de RM benaderen en kunnen leiden tot dyspneu ( figuur 1 ). Deze relatie tussen onderliggende RM-zwakte en de acute effecten van MV wordt ondersteund door de associatie tussen een lagere dikte van het diafragma bij aanvang en een verhoogd risico op het niet afbouwen van MV [ 29 ]. Van veel patiënten die het risico lopen om MV te spenen is aangetoond dat ze RM-zwakte hebben, vooral degenen die zwaarlijvig zijn [ 8 , 30 ]].
Bovendien is MIP, een maat voor de maximale RM-sterkte, geassocieerd met MV-speenresultaten [ 30 ].
Verder heeft eerder onderzoek aangetoond dat pre-operatieve RM-training (RMT) de RM-kracht en het spenen na een operatie verbetert [ 31 ].
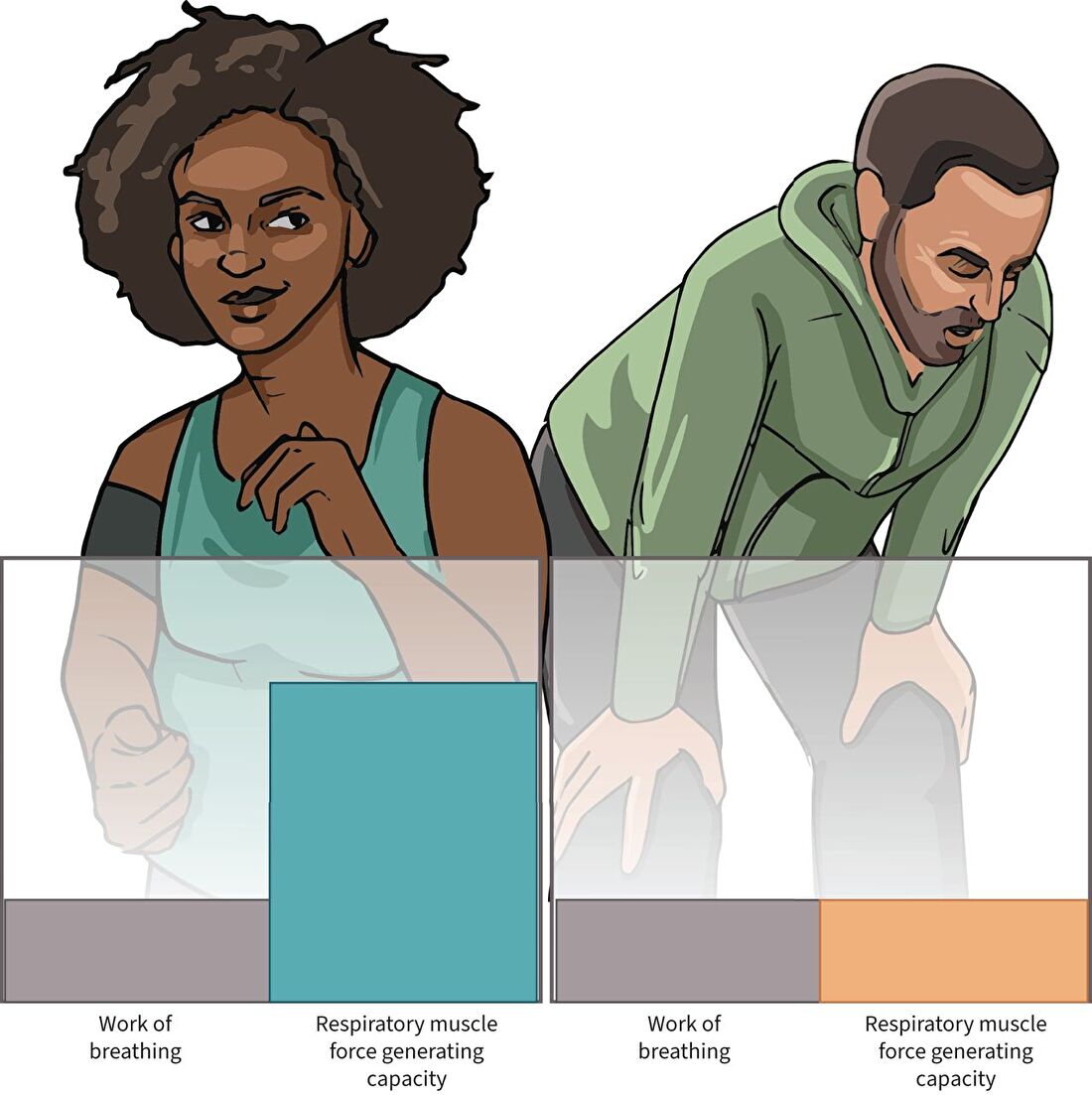
FIGUUR 1
De relatie tussen ademhalingsspierkracht en dyspneu.
Normaal gesproken werken de ademhalingsspieren met een hoge efficiëntie, waarbij de ademhalingsarbeid ver onder het krachtgenererende vermogen van de ademhalingsspieren ligt.
Deze reserve van krachtopwekkend vermogen van de ademhalingsspieren stelt individuen in staat om een toename van de ademhalingsarbeid, zoals tijdens inspanning, te tolereren zonder dyspneu te ervaren (patiënt links).
Wanneer de ademhalingsarbeid echter het krachtgenererende vermogen van de ademhalingsspieren benadert, kunnen patiënten dyspneu ervaren (patiënt rechts).
Dit kan worden veroorzaakt door een toename van de ademhalingsarbeid (verhoogde luchtwegweerstand of afname van de compliantie van het ademhalingssysteem) of een afname van het krachtopwekkende vermogen van de ademhalingsspieren.
Onafhankelijke effecten van COVID-19 op RM-prestaties
Er zijn steeds meer aanwijzingen dat een COVID-19-infectie zelfstandig schade aan de RM kan veroorzaken [ 3 ].
Deze hypothese werd geïntroduceerd door S everin et al. [ 8 ], die suggereerde dat RM een ondergewaardeerde factor kan zijn die bijdraagt aan de COVID-19-uitkomsten, met name de slechtere COVID-19-uitkomsten in patiëntenpopulaties die bekend staan om hun RM-zwakte bij aanvang en verhoogde ademhalingseisen.
Bij patiënten met obesitas kan de ademhalingsbehoefte bijvoorbeeld verdrievoudigen, en obesitas is een van de sterkste risicofactoren voor ernstige COVID-19-symptomen en slechte resultaten [ 8 ].
De veronderstelde rol van de RM in COVID-19-uitkomsten heeft verdere steun gekregen naarmate er nieuwer bewijs naar voren is gekomen.
Een post mortem onderzoek door Shi et al. [ 10 ] vergeleek het RM-weefsel van patiënten die op de IC waren opgenomen met COVID-19 met die zonder deze virale infectie.
Ze meldden dat ACE-2 tot expressie werd gebracht in het myofibre-membraan van het menselijk diafragma en vonden bewijs van virale infiltratie van SARS-CoV-2 in de diafragma-myofibres van een subset van patiënten (vier van de 26) die stierven aan COVID-19.
Belangrijk is dat, ondanks vergelijkbare duur van MV-gebruik en IC-verblijf, patiënten met COVID-19 een verhoogde expressie van genen geassocieerd met fibrose en een tweevoudige toename van zowel epimysale als perimysale fibrose vertoonden in vergelijking met patiënten zonder COVID-19 [ 10 ].
Een prospectieve observationele studie door Farr et al.[ 9 ] gebruikte echografie om de diafragma's te vergelijken van patiënten die waren opgenomen in een revalidatieziekenhuis na MV voor ernstige COVID-19-infectie (n=21) met die na MV zonder COVID-19 (n=11).
Ze ontdekten dat 76% (16/21) van de patiënten hersteld van COVID-19 ten minste één echografische afwijking van de structuur of functie van de middenrifspier had vergeleken met 45% (5/11) bij niet-COVID-19-patiënten [ 9 ].
De gemiddelde verdikkingsratio ( dwz diafragmadikte bij eindinspiratie/einduitademing) voor patiënten hersteld van COVID-19 (1,14 ± 0,19) was ook significant lager dan bij patiënten die de virale infectie niet hadden (1,53 ± 0,46) (p = 0,0278) [ 9].
Gratis eBook met veel tips over minder COPD
Er was met name geen significant verschil in de duur van MV-gebruik of circulerende biomarkers tussen de COVID-19- en niet-COVID-19-groepen [ 9 ].
Een cross-sectionele studie door H ennigs et al. [ 32 ] van de patiënten 5 maanden na de infectie met COVID-19 meldde zwakte van de RM bij 88% van alle patiënten en bij 65% van de niet-gehospitaliseerde patiënten.
Samenvattend is het duidelijk geworden dat COVID-19 direct schade aan de RM kan veroorzaken die kan bijdragen aan de aanhoudende dyspneu, vooral tijdens lichamelijke inspanning, gerapporteerd in deze patiëntenpopulatie.
Naast door COVID-19 veroorzaakte myopathische schade aan de RM, is er steeds meer bewijs dat suggereert dat COVID-19 kan infiltreren en structuren kan aantasten die betrokken zijn bij de neurale controle van de ademhaling [ 16 , 33 , 34 ].
Drie casestudies hebben eenzijdige diafragmaverlamming gemeld na COVID-19-infectie die geen verband hielden met MV of iatrogeen letsel aan de nek [ 34 , 35 ].
In elk geval rapporteerden de patiënten ernstige dyspneu na het verdwijnen van de COVID-19-infectie, maar het longparenchym was normaal op computertomografiebeelden [ 34 , 35 ].
Franz et al. [ 36] meldt een casusreeks van 32 overlevenden van ernstige COVID-19 die perifere zenuwletsels opliepen en vijf patiënten identificeerden met eenzijdige phrenicuszenuwbeschadiging.
Het is heel goed mogelijk dat veel andere gevallen van phrenic neuritis post-COVID zijn gemist, aangezien zelfs niet alle academische centra toegang hebben tot echografen met protocollen en ervaring met het scannen van de phrenicuszenuw en/of diafragma [ 37 ], waarvan is gemeld dat het beide zeer gevoelig en specifiek voor de diagnose van phrenicuszenuwletsels [ 38 ].
Een andere postmortemanalyse door B ulfamante et al. [ 39] van twee patiënten met ernstige COVID-19 vertoonden histologisch bewijs van virale infiltratie en pathologie naar het respiratoire controlecentrum.
Al met al suggereren deze rapporten dat de effecten van COVID-19 op de RM-prestaties en daaropvolgende dyspneu misschien neuromusculair van aard zijn.
Er zijn meer studies nodig om de etiologie en impact van COVID-19 op de RM-prestaties en klinische resultaten verder te onderzoeken.
Het beschikbare bewijs voor RM-prestaties die een substantiële rol spelen in de symptomologie en klinische resultaten bij patiënten met COVID-19 is overtuigend ( figuur 2 ).
Zoals eerder beschreven, lijkt alleen COVID-19-infectie myopathische schade aan de RM te veroorzaken die kan worden verergerd door acute RM-zwakte als een patiënt MV nodig heeft.
Bovendien zijn patiënten met het hoogste risico op ernstige COVID-19 populaties waar baseline RM-zwakte vaker wordt aangetroffen [ 8 ].
De combinatie van deze verschillende factoren kan verklaren waarom bepaalde demografische gegevens van patiënten geassocieerd zijn met een hoger risico op ernstige gevallen en slechtere resultaten na een COVID-19-infectie [ 8 ]].
Dit kan ook het klinische fenotype verklaren van patiënten met COVID-19-gerelateerde ARDS die een relatief normale longcompliantie hadden [ 1 , 40 , 41 ].
Ze kunnen ook de aanhoudende dyspneu verklaren die is gemeld bij COVID-19-overlevenden, ondanks dat het longparenchym onbeschadigd blijft.
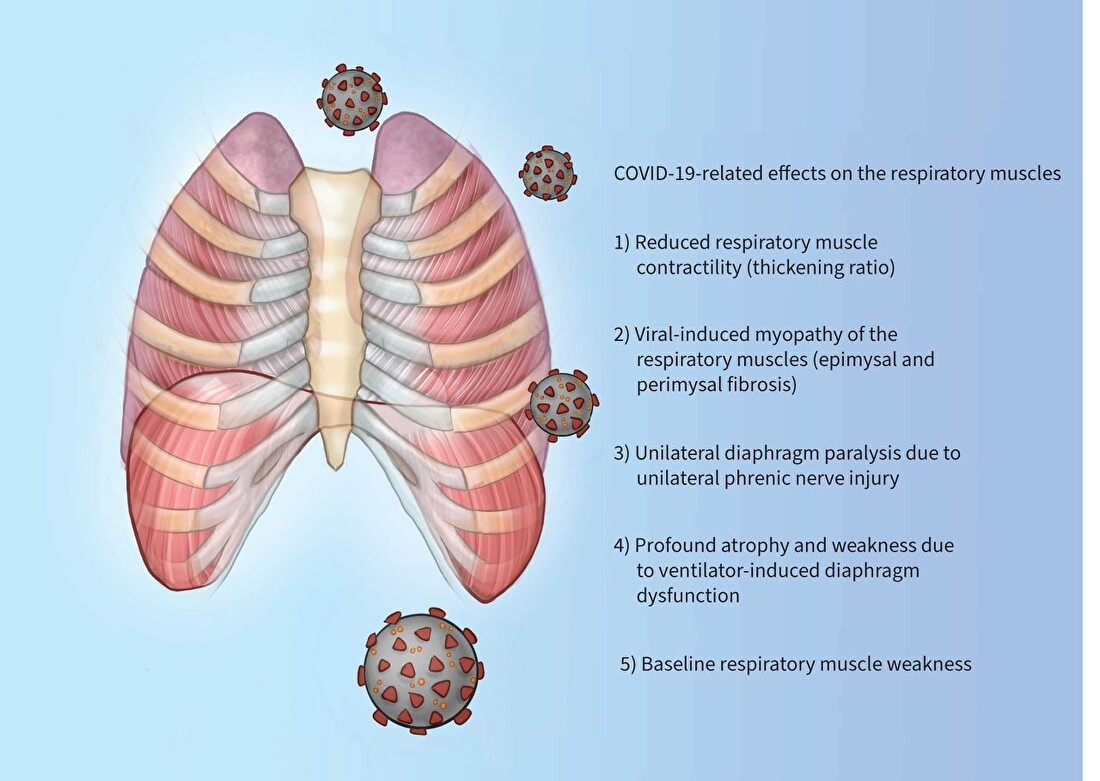
FIGUUR 2
Coronavirusziekte 2019 (COVID-19)-gerelateerde effecten op de ademhalingsspieren.
Deze figuur benadrukt de effecten van COVID-19 op de ademhalingsspieren. Sommige van deze effecten zijn te wijten aan de fibrotische schade die wordt veroorzaakt door de virale infectie [ 9 , 10 ], terwijl andere mogelijk verband houden met mechanische ventilatie en de gezondheidstoestand bij baseline [ 7 ].
De auteurs zijn van mening dat RM-prestatietesten sterk moeten worden overwogen door clinici om patiënten met een verhoogd risico op ernstige COVID-19-uitkomsten te screenen en bij het onderzoeken van patiënten met aanhoudende dyspneu na acute COVID-19-infectie.
Helaas blijft het beoordelen van RM-functie en RMT ondergewaardeerd en onderbenut in de klinische praktijk en wordt het zelden uitgevoerd [ 8 ].
Er zijn ook beperkte onderzoeken naar de rol van RMT bij patiënten met COVID-19. Gelukkig zijn beoordelingen van RM-functie en RMT eenvoudig uit te voeren [ 42 , 43 ], zijn er praktijkrichtlijnen en normatieve waarden [ 28 , 42 ] en zijn de apparaten die nodig zijn voor beoordeling en training redelijk goedkoop [ 8 ], 2288 ].
RMT
Om RMT adequaat voor te schrijven, moet een baselinebeoordeling van de RM-functie worden uitgevoerd.
Zowel in de klinische praktijk als in onderzoek worden niet-invasieve handmanometers het meest gebruikt om de RM-sterkte te meten [ 28 , 42 ].
Deze apparaten hebben een uitstekende betrouwbaarheid en zijn bovendien betaalbaar en toegankelijk [ 8 , 28 , 42 ].
Bij patiënten zonder gebruik van hun mond om te ademen, kunnen metingen worden gedaan met een neussonde voor snuifdruk [ 28 ].
De meest gebruikte maatstaf voor RM-prestaties is MIP, wat een maat is voor de piek inspiratoire spierkracht [ 28 , 42].
Om MIP te beoordelen, wordt de patiënt geïnstrueerd om volledig uit te ademen en vervolgens een maximale inspiratie-inspanning uit te voeren gedurende ten minste 1,5 s. De maximale negatieve druk die gedurende ten minste 1 s tijdens die inademingsmanoeuvre wordt aangehouden, wordt als de MIP beschouwd.
Er worden minimaal drie en maximaal acht proeven uitgevoerd met 1 minuut rust tussen de proeven [ 28 ].
Elk onderzoeksresultaat moet binnen 10% van elkaar liggen om als acceptabel te worden beschouwd, en de hoogste waarde die tijdens het testen wordt geregistreerd, wordt vervolgens gebruikt voor de MIP [ 28 , 42 ].
Naast metingen van de maximale statische inspiratoire spierkracht zoals MIP, kunnen ook metingen van het uithoudingsvermogen worden uitgevoerd [ 28 , 42 ].
Twee van de meest gebruikte testprotocollen zijn constante belasting en incrementele belasting [ 28 , 42 ].
Bij het testen van constante belasting moet de patiënt ademen tegen een submaximale constante belasting met een ingestelde cadans totdat de taak mislukt [ 28 , 42 ].
De belasting wordt geselecteerd op basis van de MIP en het wordt aanbevolen dat deze voldoende moet zijn voor de patiënt om het falen van de taak te bereiken na 5-10 minuten testen [ 28 , 42].
De primaire uitkomsten zijn de tijd tot vermoeidheid en het totale werk dat tijdens de test is verricht (testtijd×testbelasting).
Bij het testen van de incrementele belasting moet de patiënt ademen tegen een belasting die wordt verhoogd met een bepaalde hoeveelheid ( dwz 10 cmH 2 O) met regelmatige tussenpozen (tijd of aantal ademhalingen) totdat de taak mislukt [ 28 , 42 ].
De primaire uitkomsten zijn de druk van de laatste voltooide stap en de tijd tot het mislukken van een taak [ 28 , 42 ].
Voor meer informatie over MIP en andere vormen van RM-testen, waaronder expiratoire spiertesten, raden we aan te verwijzen naar de verklaring van de European Respiratory Society over RM-testen [ 28 ].
Een andere optie om te meten om de RM-prestaties te beoordelen, is de test van het incrementele ademuithoudingsvermogen (TIRE) [ 44 ].
De BAND vereist ook dat de patiënt maximaal inademt via de manometer van restvolume tot totale longcapaciteit [ 44 ].
Echter, in tegenstelling tot MIP, houdt de patiënt tijdens de TIRE ook zo lang mogelijk vol dat maximale inspiratie en inademingsdrukmetingen continu worden geregistreerd [ 44 ].
Vanwege het formaat van deze test biedt de TIRE MIP en verschillende andere metingen van RM-prestaties [ 44 ].
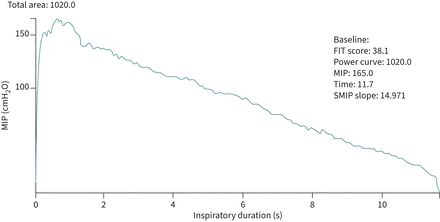
Inspiratoire duur, die wordt gemeten in seconden, vertegenwoordigt de duur van de maximale aanhoudende inademing en wordt beschouwd als een meting van RM-uithoudingsvermogen [ 44].
Aanhoudende maximale inspiratiedruk (SMIP) is het gebied onder de curve van de grafiek van inspiratiedruk gemeten in de tijd. SMIP wordt uitgedrukt in druktijdseenheden of joule en staat voor single-breath werkcapaciteit [ 44 ].
Ten slotte kan ook de helling van de SMIP
SMIP - grafiek worden gemeten en het resultaat weerspiegelt de vermoeibaarheid van de RM (hogere hellingen geven een grotere vermoeibaarheid aan)
Een voorbeeld van een opname van de TIRE en de verstrekte testgegevens wordt gegeven in figuur 3 .
Het gebruik van deze aanvullende metingen van de TIRE biedt een meer robuuste beoordeling van de RM-prestaties.
De resultaten kunnen ook verschillende kenmerken van RM-prestaties identificeren die mogelijk over het hoofd worden gezien wanneer alleen MIP wordt gemeten [ 46, 47 ].
Er zijn normatieve gegevens gepubliceerd voor de TIRE bij gezonde populaties [ 45 ].
Conclusie
Naast andere orgaansystemen suggereert het beschikbare bewijs dat SARS-CoV2-infectie kan leiden tot specifieke schade aan de RM.
Deze acute pathologie van de RM bij patiënten met COVID-19 wordt waarschijnlijk verder verergerd door onderliggende gezondheidsproblemen, effecten van MV en andere COVID-19-pathologie die de RM-prestaties schaadt en de ademhalingsarbeid verhoogt.
Deze gecombineerde factoren kunnen zowel de acute als de aanhoudende dyspneu en andere functionele beperkingen verklaren die zijn aangetoond bij patiënten met COVID-19.
De rol en werkzaamheid van RMT bij het verbeteren van dyspnoe en andere belangrijke functionele resultaten zijn algemeen bekend voor patiënten met meerdere gezondheidsproblemen.
Vanwege de directe impact van SARS-CoV2-infectie op RM-prestaties wordt het duidelijk dat RM-testen en RMT een sleutelrol zullen spelen bij de revalidatie van patiënten met COVID-19.
Echter, bewijs voor de rol van RM-testen en RMT bij de revalidatie van patiënten met COVID-19 is nog steeds in opkomst.
Verder onderzoek is nodig om de meest geschikte RM-testen en RMT-protocollen voor patiënten met COVID-19 en het effect van RMT op belangrijke functionele resultaten te bepalen.




